
扫码添加微信,获取更多半导体相关资料
摘要
研究了氨过氧化氢溶液(SC-1溶液)、Fe(III)、Ni(Ii)、Zn(II)在硅片上的吸附作用。实验结果与平衡计算结果比较发现,主要吸附物质是溶解的中性氢氧化物配合物。计算出的氢氧化物配合物吸附的自由能变化支持了这一点。
介绍
为了减少环境和设备的污染,开发和使用了多种清洁方案。SC-1溶液(29%NH4OH:31%It202:H20=1:1:5体积比)1是半导体制造中广泛使用的清洁溶液之一。然而,表面金属污染是由溶液中的一些金属杂质引起的。金属杂质,特别是过渡金属,会引起电的恶化,例如栅极氧化物的分解。
在本文中,我们通过平衡分析的方法研究了其吸附行为。采用分析方法确定了吸附种类。同时还进行了吸附的自由能计算,以了解吸附的种类,并支持平衡分析的结果。本文中检测的金属离子为Fe(III)、Ni(II)和Zn(II)作为半导体制造中的典型污染物。
实验
本工作中使用的以下化学物质为EL级,其中含有低于0.5ppb的过渡金属杂质:50%HF、29%氢氧化铵、31%H202、20%四甲基氢氧化铵。用于原子吸收分光光度法(AAS)的金属标准溶液(1000ppm)用于故意污染。本研究中使用的去离子水含有10ppt以下的过渡金属杂质。所有的过程都在一个100级的洁净室中进行,湿化学品在房间的干净通风口中进行处理。
结果和讨论
图2显示了在SC-1溶液中获得的Fe(III)、Ni(II)和Zn(II)在硅晶片上的吸附等温线。在大部分区域,表面金属浓度随溶液中的浓度单调增加。对数对数线性表明,本情况下金属离子吸附受溶液与表面的化学平衡控制。然而,表面Fe浓度在10~mol1-I以上表现出饱和趋势。这种吸附行为应该与溶液中金属离子的络合态密切相关。
通过在SC-1溶液中加入一定量的四甲基氢氧化铵来控制pH,得到了Fe、Ni、~和Zn吸附的实验pH依赖性。结果如图所示11,铁和镍对pH的依赖性明显,表明吸附种类为羟氧化物。然后将实验中pH的依赖梯度与计算出的金属氢氧化物在pH区10.5~12.0之间的金属氢氧化物分布对pH的依赖梯度进行了比较。如表二所示,pH依赖性的实验梯度与中性种Fe(III)和Ni(II)的计算值吻合较好。结果表明,吸附种类分别为Fe(OH)3(aq)和Ni(OH)2(aq)。
另一方面,本实验中表面锌的浓度与pH无关,而计算出的氢氧化物配合物的分布具有明显的pH依赖性。根据铁和镍的类比,锌的吸附种类也被认为是中性氢酰胺复合物。
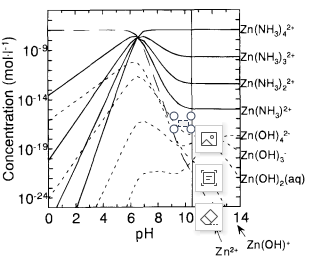
图7 计算了锌(ll)中氢氧化物和胺配合物的分布。初始浓度应为1x10-7molI-i
总结
本文通过平衡分析和自由能计算,研究了Fe(III)、NI(II(II)、锌(II)在硅片上的吸附作用,得出了以下结论:
通过溶液中的平衡分析和TXRF角扫描测量,发现在SC-I溶液中,铁的固体中性氢氧化物Fe(OH)3(s)没有吸附在硅片表面。
固体Ni(OH)2和氢氧化锌预计不会在SC-I溶液中形成,因为可溶性胺配合物占优势。
自由能计算结果表明,主要吸附物质为溶解的中性羟氧化物。Fe(III)和NIi(II)的溶解中性氢氧化物配合物,因为计算出的pH依赖分布的梯度与实验吸附梯度很好地吻合。
文章全部详情,请加华林科纳V了解:壹叁叁伍捌零陆肆叁叁叁